重庆大学生物工程学院王贵学教授团队长期从事血管生物力学与血管内支架研究,曾揭示出被科技部誉为“国际原创”的国产三氧化二砷(ATO)药物洗脱支架是一类内皮友好型支架。该款支架与常用雷帕霉素药物洗脱支架相比,在同样抑制支架内再狭窄发生的同时可以更快地促进血管损伤组织的愈合和再内皮化进程,研究成果于2018年8月以封面文章刊登在国际著名刊物Advanced Healthcare Materials上。
近期,该团队在ATO药物洗脱支架抗支架内再狭窄的生物力学作用机制方面又有了新突破,研究成果在生物医学领域1区Top期刊《Bioactive Materials》(IF: 14.593)第6卷第2期发表,报道了“YAP介导三氧化二砷调节血管平滑肌细胞表型转化以抑制支架内再狭窄发生”的力学生物学新机制,为深入认识三氧化二砷的药理学基础和防治内膜增生性心血管疾病新的用药提供建议和理论依据。
中药三氧化二砷(ATO)又名砒霜,是典型的“药毒两用”化合物。近年,ATO在治愈早幼粒细胞白血病、消除癌症干细胞和恢复结构突变型p53的抑癌功能等方面,展示了对病变细胞“改邪归正”的疗效。在动脉粥样硬化(AS)的防治应用方面,ATO具有抑制血管平滑肌细胞(VSMCs)恶性增殖的特性而进入人们的视野。然而ATO在VSMCs表型逆转分化方面的研究却鲜见有报道。
VSMCs去分化能引起细胞增殖增强,这是导致支架植入后血管再狭窄的主要原因。该研究率先探索出ATO具有促进VSMCs表型分化的作用,且伴随细胞骨架和弹性模量等细胞力学性质的改变。利用转录组测序分析和相关生化分子技术初步解析出,细胞骨架F-actin和力学响应因子YAP可以介导ATO促进VSMCs表型分化的作用机制。利用新西兰大白兔血管内支架植入及体外VSMCs表型转化模型研究了ATO对VSMCs表型转化的机制,进一步证实了YAP可部分介导ATO调节VSMCs的表型转化。
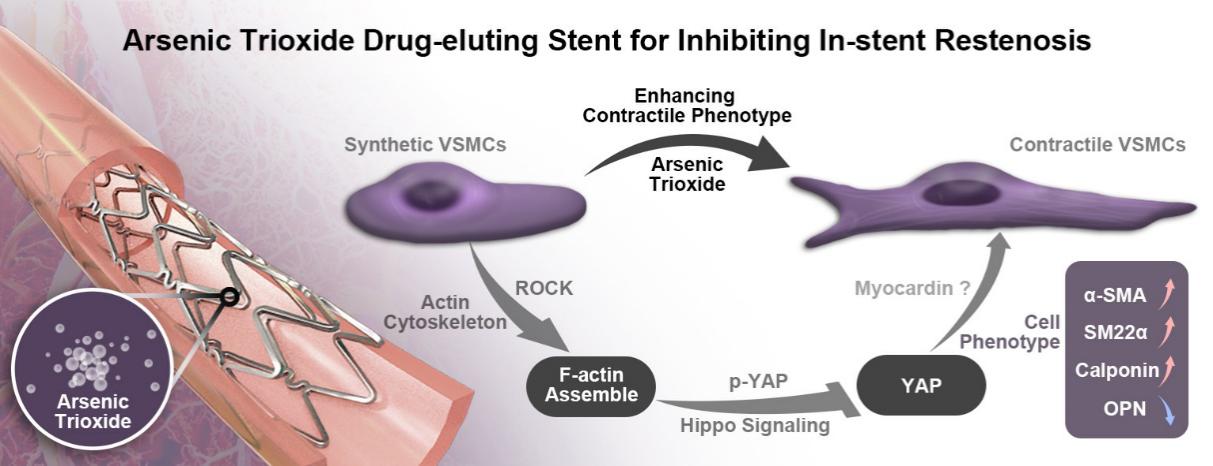
该项研究针对血管再狭窄病变,聚焦促使病变细胞正常化的“前沿”研究方向,从细胞自身力学属性及生物学性质相结合的方式以及ATO在AS领域拓展其老药新用的药理学范畴,主要揭示了ATO在抑制支架内再狭窄形成过程中调节VMSCs由合成型向成熟的收缩型转化的生物力学机制,为干预或逆转内膜增生、AS等血管重构性疾病提供新的思路和策略。
重庆大学王贵学教授为该论文的通讯作者,邱菊辉研究员为该论文的共同通讯作者,博士生赵银瓶为该论文的第一作者。近五年来,王贵学教授团队与国内外合作研究在神经血管耦合、血管生物力学与组织修复材料、动脉粥样硬化性心血管病的纳米药物治疗等领域取得突破,先后在《Nature Neuroscience》、《Advanced Science》、《Journal of Biomechanics》等国际高水平期刊发表研究论文120多篇,创新成果得到了英国剑桥大学、伦敦国王学院、瑞士苏黎世大学、美国斯坦福大学、哈佛大学、麻省理工学院以及国内北京大学、浙江大学、澳门大学等单位多名教授的肯定与引用,王贵学教授连续入选2019年和2020年爱思唯尔中国高被引学者榜单(生物医学工程领域)。
重庆医科大学、北京美中双和医疗器械公司、四川大学国家生物材料工程研究中心和英国纽卡斯尔大学为合作研究单位。该研究获得了国家自然科学基金 (31971242、31701275)和国家重点研发计划项目课题 (2016YFC1102305)等资助。
原文信息:
YP Zhao, GC Zang, TY Yin, XY Ma, LF Zhou, LG Wu, R Daniel, YB Wang, JH Qiu, GX Wang. A novel mechanism of inhibiting in-stent restenosis with arsenic trioxide drug-eluting stent: Enhancing contractile phenotype of vascular smooth muscle cells via YAP pathway. Bioact Mater. 2021, 6(2): 375-385.
原文链接:https://www.sciencedirect.com/science/article/pii/S2452199X20301912